Aprendamos sobre el amoniaco
Introducción
En esta nueva semana conoceremos algo tan común como el amoniaco resulta también muy especial. En primer lugar, porque, además de su uso como limpiador, es una sustancia fundamental en la producción de fertilizantes y, por tanto, de alimentos. Pero también tiene efectos perjudiciales para el medio ambiente por el alto consumo energético requerido en su producción. Se desarrollaron cuatro actividad didácticas para el alumno, según el artículo presentado del amoniaco.
El amoniaco está detrás de la mayor
innovación del siglo XX.
Además
de ser un conocido producto de limpieza, el amoniaco es esencial en la
fabricación de fertilizantes que, a su vez, son necesarios para producir
alimentos para el ganado y para toda la humanidad. El proceso químico para
generar este compuesto nitrogenado apenas ha cambiado en 100 años y sigue
siendo imprescindible para nuestra sociedad, aunque los científicos no saben
cómo evitar sus consecuencias negativas sobre el medio ambiente. Enrique Sacristán,
01 agosto 2018.
Cuando
durante el verano de 1909 el químico alemán Fritz Haber consiguió sintetizar amoniaco (partir de nitrógeno –el
gas más abundante de la atmósfera– e hidrógeno, poco podía imaginar la enorme
trascendencia de su descubrimiento. Años más tarde su compatriota Carl Bosch logró producir esta
sustancia a escala industrial con la ayuda de catalizadores y reactores de alta
presión. Haber y Bosch, además de recibir el premio Nobel por sus
investigaciones, dieron nombre al proceso de producción del amoniaco que no ha
dejado de utilizarse desde entonces. De hecho, el proceso de Haber-Bosch es la
innovación más significativa del siglo XX.
Así
lo recoge el estudio que investigadores de la Universidad del País Vasco han
publicado en la revista Science and Engineering Ethics, donde hacen un
recorrido histórico y detallan las tres actividades involucradas en cualquier
proceso de innovación aplicadas a la síntesis del amoniaco: adquisición y
generación de conocimiento, producción industrial y comercialización.
“Cuando acabó la I Guerra Mundial, el amoníaco
se constituyó como base insustituible en la producción de fertilizantes a gran
escala, lo que contribuyó decisivamente al crecimiento de la producción de
alimentos y de la población mundial; y todavía hoy seguimos dependiendo de este
proceso”, subraya Astrid Barona, una de las autoras.
Una gran paradoja
Pero
a pesar de su importancia, en el empleo masivo de los fertilizantes
nitrogenados se produce una gran
paradoja. Por una parte, son imprescindibles para asegurar la gran cantidad
de alimentos que consumimos tanto
nosotros como el ganado, y por otra, tienen un impacto negativo sobre el medio ambiente.
El
motivo es que el aprovechamiento real del nitrógeno que se emplea en la
síntesis industrial de fertilizantes es muy reducido, y por tanto, gran parte
acaba provocando eutrofización de las aguas, pérdida de biodiversidad y
alterando de forma negativa el balance atmosférico.
“Aunque
el proceso de Haber-Bosch, de alto consumo energético, no cumple con los
requisitos actuales de sostenibilidad, de
momento no existe alternativa que lo sustituya”, reconoce Barona, “y el
equilibrio entre las necesidades humanas y los recursos naturales sigue siendo
una asignatura pendiente”
El proceso de Haber-Bosch incluye las tres actividades principales de toda innovación: adquisición de conocimientos, preparación para la producción y preparación para la comercialización. Estas actividades no tienen que ocurrir obligatoriamente en este orden, pudiendo seguir un camino de ida y vuelta constante (indicado con las flechas circulares).
Propuesta didáctica Actividades para el alumnado
1. De forma individual, cada estudiante deberá buscar información sobre los siguientes conceptos: nitrógeno, amoniaco, fertilizantes. De esta manera poda precisar tres conceptos centrales del reportaje anterior.
- Nitrógeno
Elemento
químico, símbolo N, número atómico 7, peso atómico 14.0067; es un gas en
condiciones normales. El nitrógeno molecular es el principal constituyente de
la atmósfera ( 78% por volumen de aire seco). Esta concentración es resultado
del balance entre la fijación del nitrógeno atmosférico por acción bacteriana,
eléctrica (relámpagos) y química (industrial) y su liberación a través de la
descomposición de materias orgánicas por bacterias o por combustión. En estado
combinado, el nitrógeno se presenta en diversas formas. Es constituyente de
todas las proteínas (vegetales y animales), así como también de muchos
materiales orgánicos. Su principal fuente mineral es el nitrato de sodio.
Gran
parte del interés industrial en el nitrógeno se debe a la importancia de los
compuestos nitrogenados en la agricultura y en la industria química; de ahí la
importancia de los procesos para convertirlo en otros compuestos. El nitrógeno
también se usa para llenar los bulbos de las lámparas incandescentes y cuando
se requiere una atmósfera relativamente inerte.
- Amoníaco
El
amoníaco, también conocido como NH3, es un gas incoloro con un olor
característico compuesto de nitrógeno y átomos de hidrógeno. Se produce de
forma natural en el cuerpo humano y en la naturaleza (en el agua, el suelo y el
aire) e incluso en pequeñas moléculas de bacterias.
El amoníaco
se produce de forma natural y se encuentra en el medio ambiente: en el
suelo, el aire y el agua. El amoníaco también se renueva de forma natural como
parte del ciclo de nitrógeno que se produce mientras se fertilizan las plantas.
Como resultado de este proceso natural, el amoníaco no dura mucho tiempo en el
ambiente y tampoco es bio acumulable.
El
hidróxido de amonio, comúnmente conocido como amoníaco de uso doméstico, es un
ingrediente en muchos productos de limpieza para la casa.
El
amoníaco es un elemento fundamental para los fertilizantes de nitrato de amonio
que libera nitrógeno, un nutriente esencial para el cultivo de plantas,
incluidos los cultivos agrícolas y céspedes.
- Fertilizantes
Los
fertilizantes son sustancias ricas en nutrientes que se utilizan para mejorar
las características del suelo para un mayor desarrollo de los cultivos
agrícolas. Existen tres tipos de fertilizantes:
· Químicos: Son nutrientes elaborados por el hombre que,
generalmente, son de origen mineral, animal, vegetal o sintético. Dentro de los
fertilizantes químicos están los elaborados con los “nutrientes principales”
para la tierra, que son nitrógeno, fósforo y potasio.
Orgánicos: Son aquellos que se forman naturalmente con una nula o poca participación del hombre para su formación; pueden ser de origen mineral, vegetal, animal o mixto. Un ejemplo de fertilizante orgánico es el estiércol.
· Inorgánicos: Son sustancias derivadas de rocas y minerales que se
aplican en el suelo o sustrato para elevar la fertilidad de los cultivos. La
harina de roca es un ejemplo de fertilizante inorgánico.
Dentro de los beneficios del uso de fertilizantes en la agricultura encontramos que proveen los nutrientes que le hacen falta a la tierra o sustratos, mejoran el rendimiento de los cultivos y permiten tener una mayor producción agrícola.
2. Esta actividad se realizara como debate entre toda la clase, todos los alumnos deben participar y compartir la respuesta que hayan obtenido. Pregunta a tus padres o a los adultos de tu entorno si hay amoníaco en tu casa y para qué se utiliza. Mira, en su caso, la información del envase y describe los riesgos posibles de usarlo de forma inadecuada. Averigua también cómo se guarda y qué precauciones se adoptan para que no puedan usarlo los niños.
El
Amonio Cuaternario, es un limpiador desinfectante que tiene un amplio espectro
de eliminación de microorganismos como: virus, bacterias, hongos, levaduras.
Este
químico se debe diluir en un litro de agua para obtener una concentración adecuada
para desinfectar los pisos y otras superficies de uso frecuente. El amonio
cuaternario debe actuar por al menos cinco minutos antes de volver a usar la
superficie.
Uso y Aplicación
- ·Saneamiento general de utensilios y equipos.
- · Desinfección de hospitales, inodoros, instrumentos
médicos.
- · Desinfección en plantas procesadoras de carne y
alimentos, lecherías e industrias conexas.
- · Desinfección de ropa en lavanderías, hospitales, el
hogar, etc.
Precauciones
Este
químico se debe mantener en lugares donde los niños no puedan alcanzarlo, se
debe tener cuidado para no tener contacto con los ojos, si llegara a tener
contacto, debe lavar con abundante agua
y acudir a un medico inmediatamente.
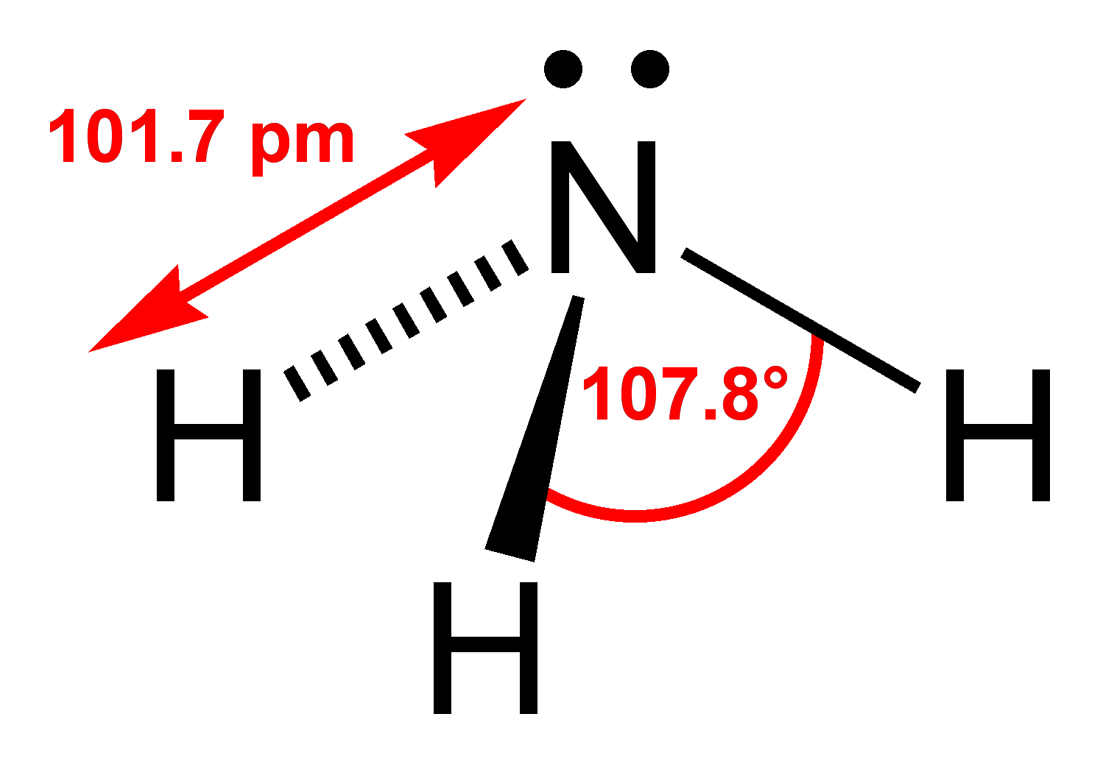
3. ¿Qué es el amoniaco como sustancia química? ¿Qué
elementos lo componen? ¿Qué propiedades tiene?
El
amoníaco es una sustancia química producida tanto por los seres humanos como la
naturaleza. Consiste de una parte de nitrógeno (N) y tres partes de hidrógeno
(H3). La cantidad de amoníaco producida cada año por seres humanos es casi la
misma producida anualmente por la naturaleza. Sin embargo, cuando se encuentra
amoníaco en niveles que pueden causar preocupación, éstos probablemente se
deben a su producción directa o indirecta por seres humanos.
Propiedades
físicas del amoniaco.
· Fórmula química: NH3
· Masa molecular: 17,03 g/mol
· Punto de ebullición: -33ºC
· Punto de fusión: -78ºC
· Densidad relativa del líquido (agua = 1g/ml): 0,68
· Solubilidad en agua: Buena (34 g/100 ml a 20ºC)
· Presión de vapor (kPa a 26ºC): 1013
· Límites de explosividad, (% en volumen en el aire): 15-28
· Temperatura de autoignición: 651ºC
· Densidad relativa del gas (aire = 1 g/ml): 0,59
4. En esta actividad formaran parejas y se realizara un
cuadro para llevar un orden sobre las aportaciones principales de ambos
investigadores ya que en el reportaje se habla de dos
investigadores alemanes que hace ya más de un siglo consiguieron sintetizar y
producir amoniaco a escala industrial.
Hace 100 años dos químicos alemanes, Fritz Haber y
Carl Bosch, encontraron una manera de utilizar el nitrógeno del aire para hacer
amoníaco, con lo que se hacen los fertilizantes indispensables para la alta
producción de cultivos.
|
Fritz Haber |
Carl Bosch |
|
· Proceso Haber-Bosch. · Transformó el nitrógeno del aire para hacer amoníaco, para utilizarlo en la fabricación de fertilizantes que las plantas pueden utilizar para crecer. · Independizó
la síntesis del amoniaco y de productos nitrogenados, tales como
fertilizantes, explosivos y materias primas químicas
|
· Proceso Haber-Bosch. · Los
métodos químicos a presiones elevadas que inventó y desarrolló permitieron
emplear el gas amoniaco en la fabricación de abonos artificiales. · Para llevar a cabo el proceso utilizó recipientes a 500°C de temperatura y 200 atmósferas de presión.
|

Reflexión:
En esta semana, estudiamos y aprendí lo importante que es conocer sobre el amoniaco, en realidad no tenía mucho conocimiento sobre este tema, aprendí que el amoniaco viene en otras sustancias que nosotros utilizamos para limpiar en nuestros hogares, es un elemento importante para los fármacos, lo podemos reconocer fácilmente por su olor.
También aprendí que esta sustancias también la produce por los seres humanos como la naturaleza, muchas personas lo utilizan para fertilizantes y en ocasiones para explosivos.
El tema que nos llevó a esta actividad fue La alfabetización científica y la cultura científica. La intención de realizar esta actividad de lectura de un artículo científico, seleccionado de entre los que se les sugierieron, y la posterior resolución parcial de la guía didáctica para el alumno, era precisamente autoanalizar el nivel de alfabetización científica y de cultura científica que cada uno posee y ha desarrollado hasta este momento de la vida. Lamentablemente eso no aparece reflejado en la entrada que usted compartió.
ResponderEliminar